Шалом, хатулим. Сходу забайчу на комми-срач и скажу, что жизнь — это способ существования белковых тел. Значит, чтобы эту жизнь изучать, надо изучать белки. Аминокислотный состав, конформации, размер, изоэлектрическая точка — вот эти все радости макромолекулярного бытия. А чтобы изучать белки, надо... как следует заебаться.
Дело в том, что крайне редко удаётся поработать с единственным чистым белком. Как правило, в наличии имеется смесь белков, и хорошо, если исключительно белков. Собственно, все нерадости макромолекулярного бытия начинаются именно тут — с разделения смеси. Во-первых, это долго и дорого. Подбор растворителей, колонок и наполнителей, сбор и анализ фракций — если это хроматография; подбор последних шекелей с гранта — если это спектроскопия или, прости Господи, ЯМР. Во-вторых, белки обожают денатурировать, и когда это не твоя подгоревшая утренняя яичница, то несвоевременная денатурация может накрыть медным тазом весь анализ, и хорошо, если в самом начале процесса. В-третьих, это долго и дорого. Я повторяюсь? Да иди ты! Конечно же, я повторяюсь — ведь для репрезентативного анализа нужна воспроизводимость, так что изволь пройти все этапы несколько раз, увеличивая затраты сил, денег и времени пропорционально.
Однако можно сделать всё гораздо быстрее и дешевле. Если поднапрячься. В смысле — подать напряжение.
С электролизом вы должны быть знакомы со школьной скамьи. Положительные ионы движутся к отрицательно заряженному электроду, отрицательные — к положительному. Происходят реакции согласно ряду электрохимического напряжения металлов, бла-бла-бла, держи свой трояк за четверть. Если не касаться практического применения и получения всякого прикольного дерьма типа концентрированной перекиси, гальванических покрытий и тяжёлой, мать её, воды, то всё достаточно скучно.
А вот если мы запихнём в водный раствор решётку? А если увеличим размер частиц? А зачем накуривать осу?
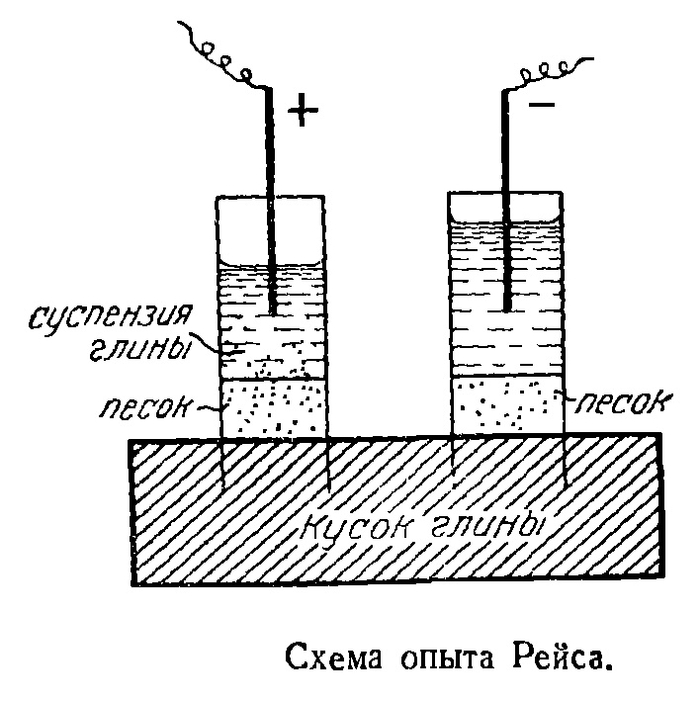
Как-то раз в начале XIX века один учёный херр Фердинанд-Фридрих Рейс вместе с другим учёным хером Петром Ивановичем Страховым обнаружили, что коллоидные частицы могут двигаться в жидкой среде под воздействием электрического поля. Конкретно же они увидели, что подача напряжения на влажную глину через водяной столб вызывала перемещение частиц глины и образование суспензии в воде. Сие явление окрестили электрофорезом.
Электрофорез оказался на диво полезной штукой. Им оказалось весьма удобно осаждать рассеянные в воздухе частицы, что сильно упростило жизнь трудяг химтеха. Им можно троллить детей постсовка (байт на комми-срач х2), приглашая на физпроцедуры сомнительной эффективности. Им можно троллить сторонников докмеда, приглашая детей постсовка на физпроцедуры сомнительной эффективности.
Ну и самое главное — им можно делить смеси белков.
Белки, как и большая часть биомолекул, в растворе имеют заряд, следовательно, могут двигаться к противоположно заряженному электроду. Очевидно, что скорость движения частицы будет пропорциональна её заряду. Можно ли добавить что-то ещё? Конечно. Помните, я говорил про решётки и воду? Оказывается, что раствор — понятие весьма растяжимое. Рейс и Страхов вообще использовали жидкую глину. Мы же для фореза белков будем использовать гель. Ещё можно использовать капилляры, целлюлозные мембраны, хроматографические колонки, даже небо, даже Аллаха, но мы будем использовать гель.
Потому что он простой, дешёвый и классный. И у него есть нужная нам пространственная структура. А именно — решётка из макромолекул с ячейками подходящего размера, заполненными дисперсионной средой — просто водичкой фиксированной кислотности, в простонародье буфером. В роли макромолекул возьмём крахмал, агарозу и полиакриламид, благо они дешевы, устойчивы к высокому напряжению и обладают ячейками подходящего размера. И вот эти вот ячейки как раз нам и дают последний недостающий элемент — способность разделять белки по размеру.
Как это всё работает на практике? Или хотя бы на пальцах?
Представьте себе московское метро в час пик. Ленивая сонная масса толпится возле эскалаторов, но там и тут сквозь неё прут отдельные опаздывающие граждане. И, кхм, сила гражданского прения зависит от двух факторов: наглости индивида и его размера. Мелкий и напористый пролезет дальше, пухленький и скромный — застрянет. Белки будут двигаться похожим образом: крупные молекулы, как и крупные граждане, будут застревать в ячейках пространственной решётки, а мелкие протиснутся дальше. Наглые ублюдки тоже пролезут глубже — подобно тому как белки с большим зарядом будут дальше продавлены электродами.
Ладно, пора выходить из подземки убогих ассоциаций в реальный мир. На Менделеевской, фить-ха!
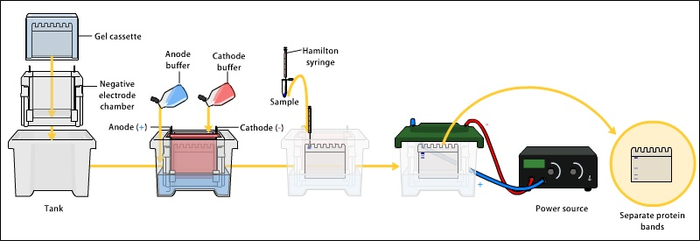
Попробуем для начала разделить белки по массе. На всякий случай напомню, что для макромолекул масса эквивалентна размеру. Для этого нам нужно сначала нивелировать эффект заряда, так что сварим наши белки сначала в восстанавливающей среде, а потом в додецилсульфате натрия (SDS). Такая обработка позволит нам игнорировать денатурирование белков — потому что, кхм, денатурирует их все, везде и сразу до первичной линейной структуры. Заодно SDS связывается с белками, обеспечивая им равномерный поверхностный отрицательный заряд. Вносим нашу смесь белков в полиакриламид (PAG) и добавим красителя, чтобы можно было оценить ход электрофореза. Включаем напряжение — и вуаля! Теперь наши белки будут двигаться в геле пропорционально логарифму собственной молекулярной массы. По размеру и количеству окрашенных пятен можно будет оценить как количество, так и массу белков в смеси. Анализ немудрёно называется SDS-PAGE, где до значения буковки E автор предлагает догадаться дотошному читателю самостоятельно.
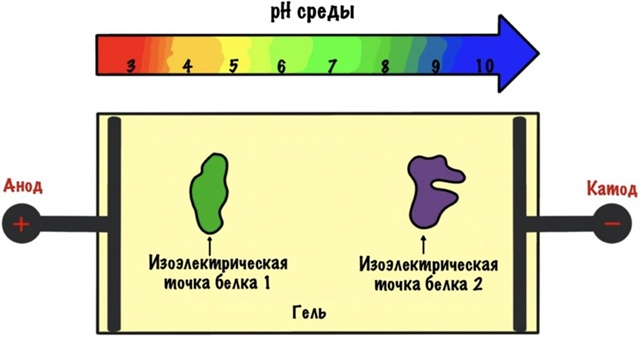
Окей, а что делать с белками примерно одного размера? Делить их по заряду, конечно. У каждого белка есть такая изоэлектрическая точка — значение pH среды, при котором молекула не несёт никакого поверхностного заряда. И, в отличие от загадочной точки G, эту можно найти. Модифицируем наш гель: с помощью буферов и такой-то матери создадим градиент кислотности на его поверхности. Двигаясь под напряжением в таком геле, наш белок тупо остановится в зоне pH, соответствующей его изоэлектрической точке. Потому что нет у него больше никакого заряда — двигать нечего. Метод весьма чувствителен и позволяет делить белки, отличающиеся в значении pH изоэлектрической точки всего на сотую долю единицы.
Ну хорошо, а дальше что? Да что угодно! Всего после этих двух анализов перед вами простирается русское электромагнитное поле экспериментов. Можете изолировать белки, устанавливать количество денситометрией, искать нужный белок вестерн-блоттингом, заняться аминокислотным анализом, оптимизировать метод анализа и упороться с хроматографией — можете делать вообще всё, что угодно. Ещё раз: Всё. Что. Угодно. — ведь вместо злоебучей белковой смеси у вас теперь аккуратненькие красивенькие индивидуальные протеиновые пятнышки. Удовольствие, а не работа.
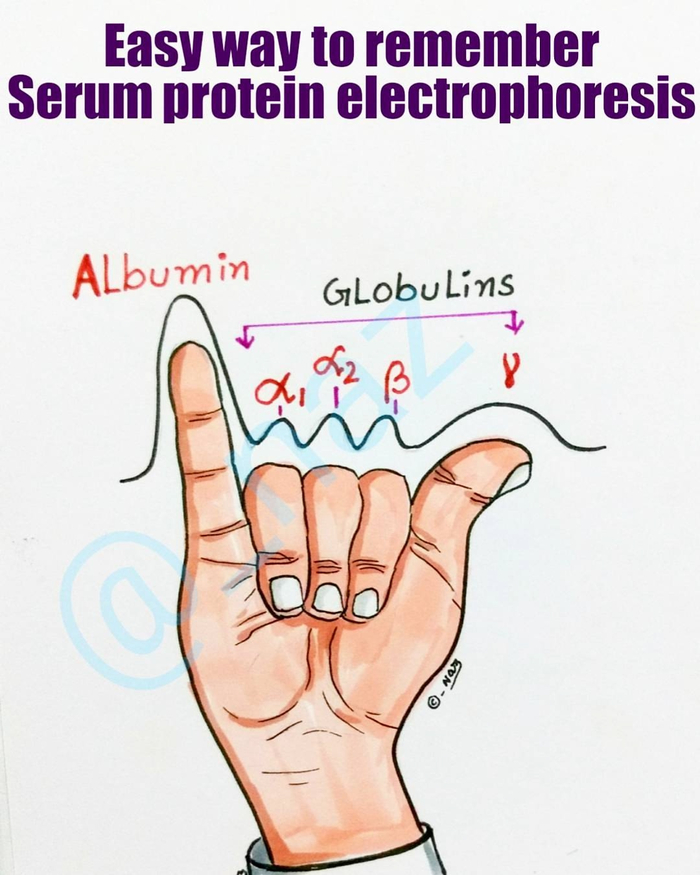
Короче, электрофорез — база. Не потому, что его на изичах можно сделать на кухне в холодце... А, не, погодь — именно поэтому. Именно потому, что это настолько просто и доступно, современная биохимия, так сказать, буквально начинается с электрофореза. С него, родимого, начинают анализ белковых смесей подавляющее количество лабораторий — и уже только потом кумекают, что делать дальше. Или тупо делят без всякого анализа, потому что препаративный форез тоже работает как часы. Стоит ли говорить, что ушлые медики тоже взяли анализ на вооружение и теперь, чтобы запомнить электрофоретическую альбуминограмму, кидают плотную джамбу?
Ах да, вы думаете, про холодец я ради красного словца приписал? Наивные. Вот вам ссылка на чувака, который отринул низменное, принял сверхчеловеческое — и поставил электрофорез в холодце. В натуральном, мать его, холодце. С красителями, экстрагированными из M&M’s, и охлаждающей системой из мороженой гавайской смеси. И всё сработало.
Так что в следующий раз, когда вы засунете на кухне электроды в желешку, на ласковый вопрос родителей «Что ты делаешь, придурошный?» можете смело отвечать: «Science, bitch!»
P.S. За количество звёздлюлей, выписанных читателю в ходе кухонных экспериментов, ни автор, ни администрация ответственности не несут — но покекают над вами с удовольствием.
Ещё нас можно читать в ВК, телеге и Дзене
Подписывайтесь, чтобы не пропустить новые посты!